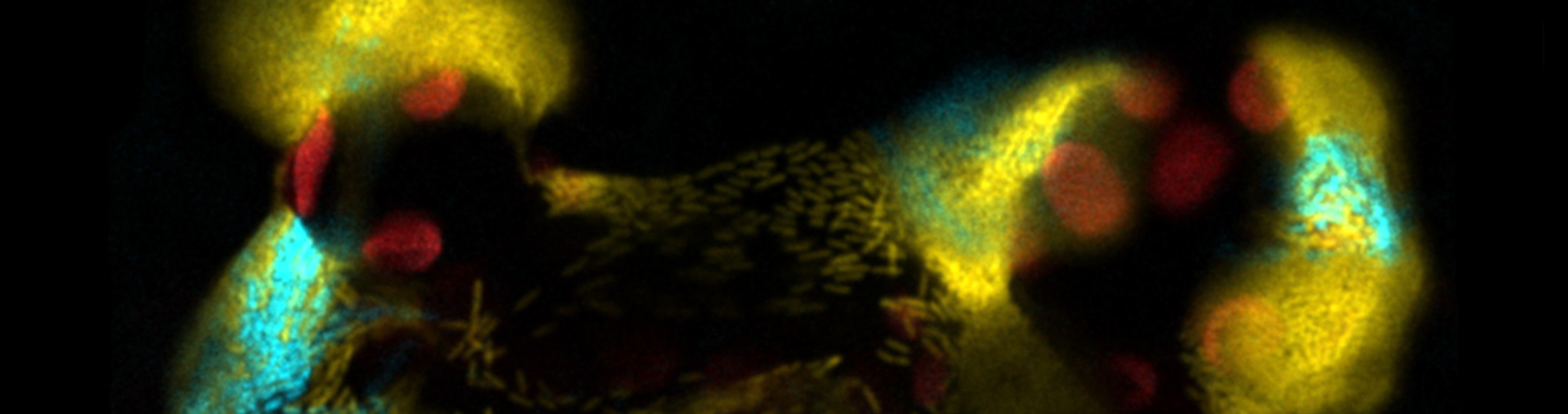
Los patógenos bacterianos codifican sistemas de virulencia que facilitan la colonización del tejido vegetal y entregan proteínas de virulencia para suprimir las defensas de la planta. Pseudomonas syringae es una bacteria fitopatógena, relevante tanto como modelo académico como agronómico. La capacidad de P. syringae para adaptarse a diferentes nichos es un aspecto importante de su éxito epidemiológico. La virulencia de P. syringae se basa en su sistema de secreción de tipo III (T3SS) para introducir efectores dentro de la célula huésped de la planta, donde estos pueden suprimir la activación de las vías de defensa, permitiendo que el patógeno prolifere y colonice el apoplasto de la hoja. Sin embargo, nuestro trabajo ha demostrado que solo una parte de la población bacteriana activa la expresión de los genes del T3SS dentro del apoplasto. Es más, la expresión del T3SS en poblaciones clonales de P. syringae es biestable en medio de inducción del T3SS: con una subpoblación de bacterias T3SSON y otra subpoblación T3SSOFF. Estas subpoblaciones presentan diferencias en virulencia. Otro activo importante en la capacidad de P. syringae para adaptarse a diferentes nichos es el sistema flagelar, que proporciona movimiento y facilita el acceso a los nutrientes o al interior de la hoja. El filamento flagelar también es un inductor de las defensas de las plantas. Por tanto, la expresión dentro del apoplasto está regulada a la baja. Este proyecto analizará y caracterizará la expresión del flagelo en la población, dentro y fuera de la planta, y en relación con la expresión del T3SS.
La activación estocástica de la expresión génica en poblaciones clonales se puede determinar mediante mecanismos epigenéticos, p. Ej. metilación del ADN. Resultados del equipo nos ha permitido establecer los metilomas de dos de las principales estirpes modelo de P. syringae (patógenos de judia y tomate respectivamente) donde hemos identificado varios motivos de metilación, diferentes en cada cepa, abundantes en regiones promotoras y que muestran una superposición potencial con motivos de unión para factores de transcripción (TF). La superposición entre los sitios de unión de TF y la metilación es una característica clásica de la regulación epigenética de la expresión de genes estocásticos. Muchos de los sitios de metilación dentro de los genomas de estas dos cepas de P. syringae aparecen hemimetilados o no metilados, lo que sugiere que pueden estar involucrados en la regulación génica. Además, varios sitios de metilación (en parte sin metilar) se encuentran dentro de las regiones promotoras de reguladores clave de T3SS, vinculados previamente en nuestro laboratorio a la expresión biestable de los genes T3SS y probablemente involucrados en la regulación entre la expresión de T3SS y el sistema flagelar. Este proyecto caracterizará el papel de las metilasas de ADN en la regulación geníca en estas estirpes de P. syringae y en la generación de heterogeneidad fenotípica de loci relacionados con la virulencia en este patógeno.
La activación estocástica de la expresión génica genera heterogeneidad fenotípica en ausencia de diferencias genéticas y puede tener valor adaptativo. También investigaremos el papel que juegan las diferentes subpoblaciones en la adaptación a la planta en diferentes contextos de defensa y patosistemas, y si estos son importantes para la resistencia de la planta o la resistencia de patógenos a otros estrategias de control.
Código
PID2021-127245OB-I00
DURACIÓN
1 septiembre 2022 – 31 agosto 2025
Entidad financiadora
MCIN/ AEI/10.13039/501100011033/
INVESTIGADOR/A PRINCIPAL
Carmen Beuzón López & Francisco Javier Ruiz Albert




